上海生物制品宿主细胞蛋白(HCP)残留检测抗体覆盖率验证
关键词: 上海生物制品宿主细胞蛋白(HCP)残留检测抗体覆盖率验证 宿主细胞蛋白(HCP)残留检测

 2025.12.04
2025.12.04
文章来源:
HCP 是宿主细胞(多为哺乳动物细胞或微生物)所产生的蛋白质,这类蛋白质存在潜在风险,可能对药物的安全性与有效性产生影响。因此,宿主细胞蛋白(HCP )残留量成为生物药物的关键质量属性,需在药物开发与生产阶段,对 HCP 的存在进行严格监控、管理并做好记录。随着生产流程推进,生物制品纯度逐步提升,但 HCP 的总量与种类也在不断减少,这无疑增加了 HCP 分析与监测工作的难度。在此背景下,开发高效的 HCP 富集材料及技术便显得尤为重要。低丰度宿主残留蛋白富集试剂盒,专为富集生物制品(如单抗、融合蛋白等)中的 HCP 并去除高丰度蛋白而设计,其通过磁珠法构建多样化且复杂的亲和配体库,以实现对目标蛋白的高效识别与结合。该试剂盒的设计不仅覆盖传统单一蛋白,还可适配融合蛋白、单克隆抗体等多种生物样本类型,体现出较强的适用性与灵活性。以高分辨蛋白质谱技术平台为支撑,湖州申科整合 IMBS 技术,创新建立 IMBS-MS 抗体覆盖率评估方法。上海生物制品宿主细胞蛋白(HCP)残留检测抗体覆盖率验证
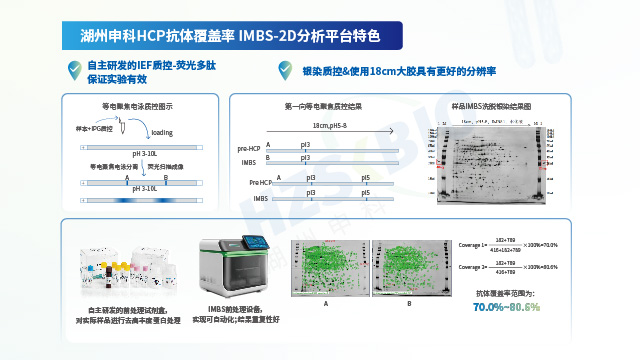
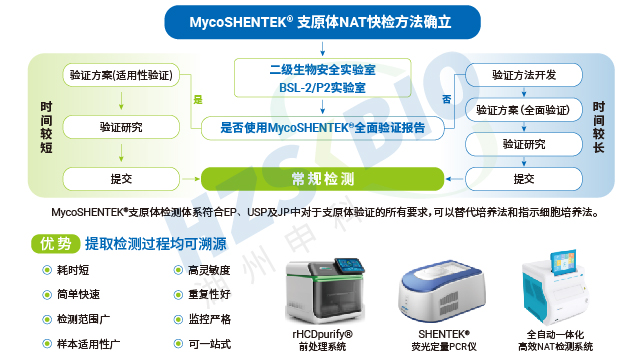
HCP 试剂盒筛选需纳入线性稀释(一步法重点关注)、抗基质干扰、检测稳定性、批间一致及工艺适配性。上海生物制品宿主细胞蛋白(HCP)残留检测抗体覆盖率验证

- 江苏细胞基因治疗产品用宿主细胞蛋白(HCP)残留检测试剂盒 2025-12-02
- 北京内毒素检测 2025-12-02
- 上海热原检测法规要求 2025-12-01
- 浙江疫苗内毒素检测风险评估 2025-12-01
- 北京非动物源内毒素检测低内毒素回收 2025-12-01
- 江苏细菌内毒素检测方法验证 2025-12-01
- 宿主细胞残留DNA检测核酸提取 2025-11-28
- 北京内毒素检测LER现象 2025-11-28



- 01 陕西步态评估系统 临床
- 02 西藏智能盘点智能物联网料盒供应商
- 03 天津作用助腿器价格
- 04 云南比较好的内镜洗消追溯系统系统供应商
- 05 佛山婴儿防盗系统厂家哪里找
- 06 甘肃取石球囊型号
- 07 云南超声波身高体重仪厂家供应
- 08 河北nmn货源厂家
- 09 青海耐用藏香城市
- 10 嘉兴住院阳生智能采样预约管理平台