芜湖国内注册eCTD报价
关键词: 芜湖国内注册eCTD报价 eCTD

 2025.12.20
2025.12.20
文章来源:
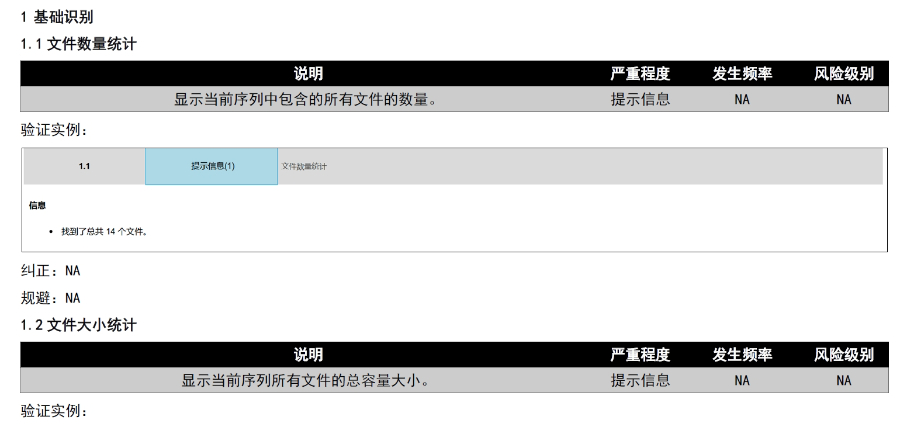
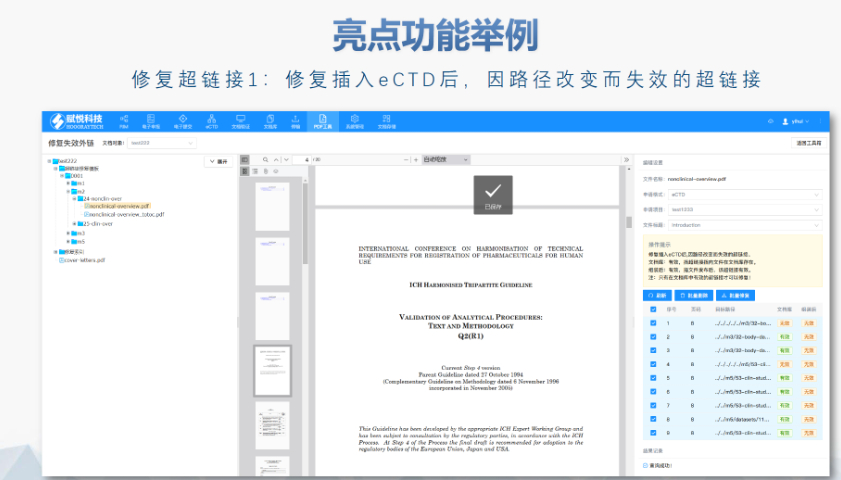
内容与格式检查Word预处理:需检查拼写、缩略语、单位格式(如),设置多级列表自动编号(如),统一字体(宋体/TimesNewRoman)和段落格式。重复内容处理:相同剂型不同规格可共用模块3,但需区分包装系统(如、)。外文资料:中文在前、原文在后,参考文献需中英文对照并建立跨网页链接。使用符合ICH标准的eCTD编辑器自动生成XML骨架和MD5校验值,拖拽PDF文件构建结构树。序列管理:序列号从0000开始递增,每次提交需更新序列,生命周期状态(New/Replace/Delete)需在XML中明确标注。验证与递交:确保无验证错误(如书签缺失、超链接断链),通过ESG等电子通道传输,光盘封面需包含申请号和序列号。全生命周期管理版本:通过软件实现网页签入/签出、审批流程,支持历史版本追溯。变更管理:增补(Append)和替换(Replace)需关联原始序列,删除(Delete)需彻底移除无效文件。瑞士eCTD申报软件相关技术支持。芜湖国内注册eCTD报价
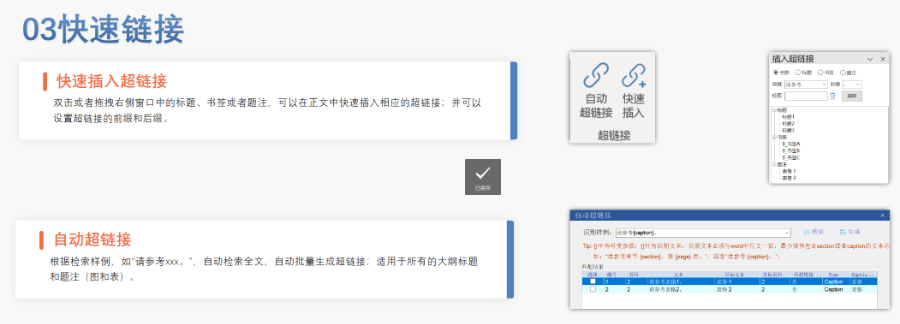
设施费动态调整 API工厂和制剂工厂年费分别约6.8万和14.5万美元(2025财年),CMO工厂费用为制剂费的24%。国外工厂需额外支付1.5万美元跨境检查费。 缴费时限与惩罚 费用需在财年首日(10月1日)起20天内缴纳,逾期将列入拖欠名单并暂停ANDA受理,涉事药品视为冒牌产品。 豁免与特殊情形 PET药物、非商业产品及停产超一年的工厂可豁免缴费。已缴费工厂若年度内无生产活动,仍需缴纳费用。 行业影响与策略 费用上涨推动企业优化申报策略,例如集中ANDA提交周期、采用CMO外包降低设施费,并通过预认证(如DMF完整性评估)减少重复支出。浙江国内注册eCTD销售电话欧盟eCTD注册外包相关技术支持。
紧急申报与特殊通道:FDA设置紧急申报通道(如Pre-EUA和EUA),允许在公共卫生事件中快su提交资料。此类申请需在模块,并通过ESG加急处理。eCTD版本兼容性与过渡策略:eCTD,允许。企业需在2024年前完成系统升级,确保XML到HL7RPS的格式转换。过渡期间需同时维护旧版本系统。区域差异与全球化协调:美国模块1要求严格,如UUID标识符和组合申请支持,而欧盟侧重文件引用合规性。FDA与PMDA、EMA通过ICH框架协调eCTD标准,但区域特殊性仍需针对性适配。行业影响与长期价值:eCTD不是技术升级,更是全球yao品监管一体化的驱动力。其标准化、可追溯性和效率提升,推动了跨国多中心试验的协同申报,加速创yao上市进程。
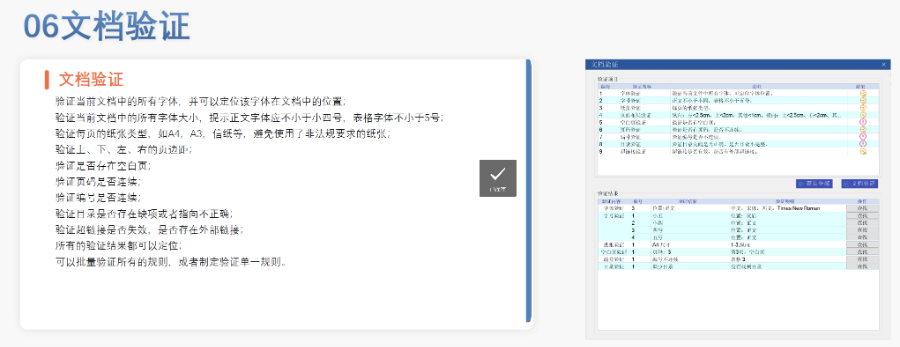
电子递交的合规性与FENG险管理欧盟要求申请人确保电子资料与纸质版本完全一致,若未在规定时间提交纸质文件可能导致注册终止。验证过程中,“错误”级别问题(如文件命名不规范、XML逻辑错误)必须修正,而“警告”和“提示信息”则建议优化以提升审评体验。EDQM和EMA均提供验证工具,申请人需在递交前完成内部预验证。G方费用结构与支付流程欧盟eCTD递交费用因审评程序类型而异:集中程序费用较高,涵盖科学评估和合规审查成本;G家程序费用由各成员国自行设定。CEP申请需向EDQM支付评审费,具体金额根据原料YAO类型和变更复杂度分级。缴费需通过G方指定渠道完成,并附上付款凭证作为模块1的组成部分。多语言支持与翻译要求尽管欧盟允许使用英语提交,但部分成员国要求模块一的行政文件翻译为本地语言。临床试验数据库(如SDTM和ADaM)需以英语呈现,同时提供双语标签以支持多国审阅。Z业翻译服务在确保技术术语准确性方面至关重要,尤其针对复杂YAO学和非临床数据。欧盟ANDA注册申报相关技术支持。

美国于2003年成为全球早采用eCTD(电子通用技术文档)的国家之一,初由CDER和CBER作为电子提交平台试点。2008年起,eCTD正式成为药申请(NDA)和生物制品许可申请(BLA)的标准格式,并在2012年通过《药申报者付费法案》(PDUFA)进一步强化其法律地位。至2017年,FDA强制要求所有药申请(NDA)、简略药申请(ANDA)及药物主文件(DMF)必须采用eCTD格式提交,标志着其从可选到强制的转型。这一进程在2018年扩展至临床试验申请(IND),终实现全类型药品注册的电子化覆盖。欧盟eCTD申报软件相关技术支持。太仓eCTD找哪家
澳大利亚ANDA注册申报相关技术支持。芜湖国内注册eCTD报价
欧洲YAO品管理局:集中审评程序由欧洲YAO品管理局(EuropeanMedicinesAgency,EMA)负责协调。人用YAO品委YUAN会:人用YAO品委YUAN会(CommitteeforMedicinalProductsforHumanUse,CHMP)负责提供科学意见。欧盟委员会:CHMP的意见随后被提交给欧盟委YUAN会(EuropeanCommission,EC),由欧盟委会做出是否授权的终决定。这个决定在整个欧盟都是具有法律约束力的。审批过程:申请人向EMA提交申请,包括eCTD(电子通用技术文档)格式的YAO品注册文档。EMA的CHMP分配一个科学评估团队(Rapporteur和Co-Rapporteur),负责初步评估。CHMP基于评估团队的报告提供科学意见。欧盟委会根据CHMP的意见做出终决定,批准或拒绝YAO品上市。授权范围如果YAO品获得批准,将获得在整个欧盟、冰岛、列支敦士登和挪威YOU效的上市许可(CentralMarketingAuthorisation,CMA)。 芜湖国内注册eCTD报价

- 工业园区中国eCTD服务价格 2025-12-18
- 上海国内注册eCTD服务价格 2025-12-18
- 芜湖化学药品eCTD发布软件 2025-12-18
- 浙江ANDAeCTD哪个品牌好 2025-12-18
- 宁波电子申报eCTD哪家好 2025-12-18
- 徐汇区NDAeCTD软件 2025-12-17
- 吴江区赋悦科技eCTD服务电话 2025-12-17
- 浦东新区CDE eCTD注册系统 2025-12-17



- 01 湖北工业4.0工控机价格
- 02 辽宁电动合唱话筒升降器上门安装
- 03 安徽zt410斑马打印机官网
- 04 广州2513吧唧UV打印机制造商
- 05 新疆不花钱的wms仓储管理系统
- 06 天津晶圆YMS多少钱
- 07 达拉特旗科创电子AISaaS智能营销云平台是干嘛的
- 08 山东云服务器云服务器哪里买
- 09 会议 液晶屏升降器调节
- 10 中国香港超频服务器哪里买